Simoa™ Essais basés
SIngle MOlecule Array (Simoa™) est une plateforme d’immunoessai robuste et très sensible, fabriquée et entretenue par Quanterix Corporation. Cette technologie est utilisée pour la détection et la quantification de biomarqueurs à des concentrations aussi faibles que celles du femtogramme. Les tests Simoa™ sont utilisés pour l’évaluation des biomarqueurs dans de multiples disciplines médicales, notamment l’auto-immunité, l’inflammation, les maladies infectieuses, la neurologie, la cardiologie et l’oncologie. La flexibilité de Simoa™ permet la détection de biomarqueurs à partir de nombreux types d’échantillons, notamment le sang, le sérum, le plasma, le liquide céphalorachidien (LCR), l’urine, le lavage bronchoalvéolaire (LBA), les surnageants de culture cellulaire et les lysats cellulaires. La robustesse de la plateforme est encore renforcée par la possibilité d’effectuer des analyses simples et multiplex.
Comment cela fonctionne-t-il ?
La technologie de SimOa™ est basée sur la formation de complexes immunitaires « en sandwich » sur des billes paramagnétiques qui sont ensuite isolées dans des puits de la taille d’un femtolitre.
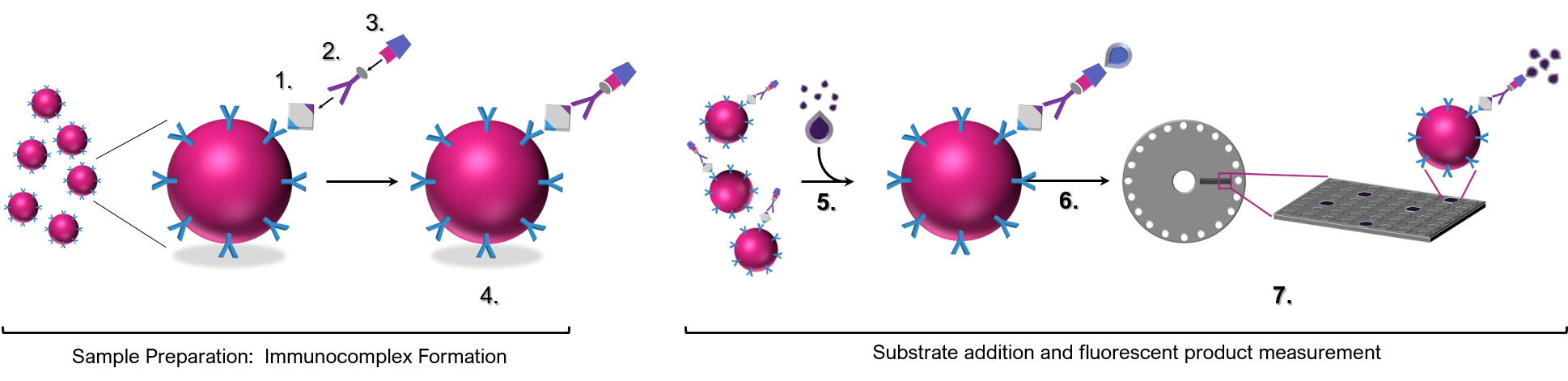

Des billes paramagnétiques couplées à des anticorps spécifiques de la cible (ou des antigènes si l’intérêt est les anticorps dirigés contre des cibles spécifiques) sont incubées avec l’échantillon, des anticorps de détection secondaire biotinylés et des conjugués d’enzymes streptavidines pour former des complexes immuns capables de générer un signal fluorescent sur les billes individuelles. Les perles sont ensuite mélangées avec un substrat enzymatique et chargées dans des disques de chargement d’échantillons contenant des puits de la taille d’un femtolitre qui permettent d’isoler des perles uniques dans un seul puits. La sensibilité accrue de l’essai par le piégeage d’une bille dans un puits permet une mesure « numérique » d’une seule molécule d’analyte dans le complexe immunitaire concerné. Les concentrations de l’analyte sont déterminées par extrapolation à partir d’une courbe standard générée lors de chaque essai. Combiné à des mesures analogiques pour des concentrations plus élevées de l’analyte, le système Simoa™ garantit la précision et la reproductibilité des résultats sur une large gamme dynamique.
Essais immunologiques de ligne (LIA)
Les immunoessais en ligne (LIA) sont des immunoessais linéaires où plusieurs antigènes sont adsorbés individuellement en parallèle à une phase solide (par exemple le nylon) sur une seule bandelette de test. Les immunoessais en ligne sont des méthodes utiles car ils permettent de différencier, avec une grande spécificité, la réactivité des anticorps à de multiples antigènes. Les immunoessais en ligne sont des méthodes utiles car ils permettent de différencier, avec une grande spécificité, la réactivité des anticorps à de multiples antigènes.
Comment cela fonctionne-t-il ?
Les immunoessais en ligne sont basés sur la formation de complexes immuns marqués d’antigènes qui sont liés à une phase solide (les phases solides sont souvent des bandes de test en nylon individuelles). Les antigènes multiples sont adsorbés (avec des lignes de contrôle pour confirmer la fonctionnalité du test) pour former une bandelette de test d’antigènes multiplex. Les LIA peuvent générer un profil d’anticorps qualitatif et semi-quantitatif complet pour un échantillon donné sur une seule bandelette de test.
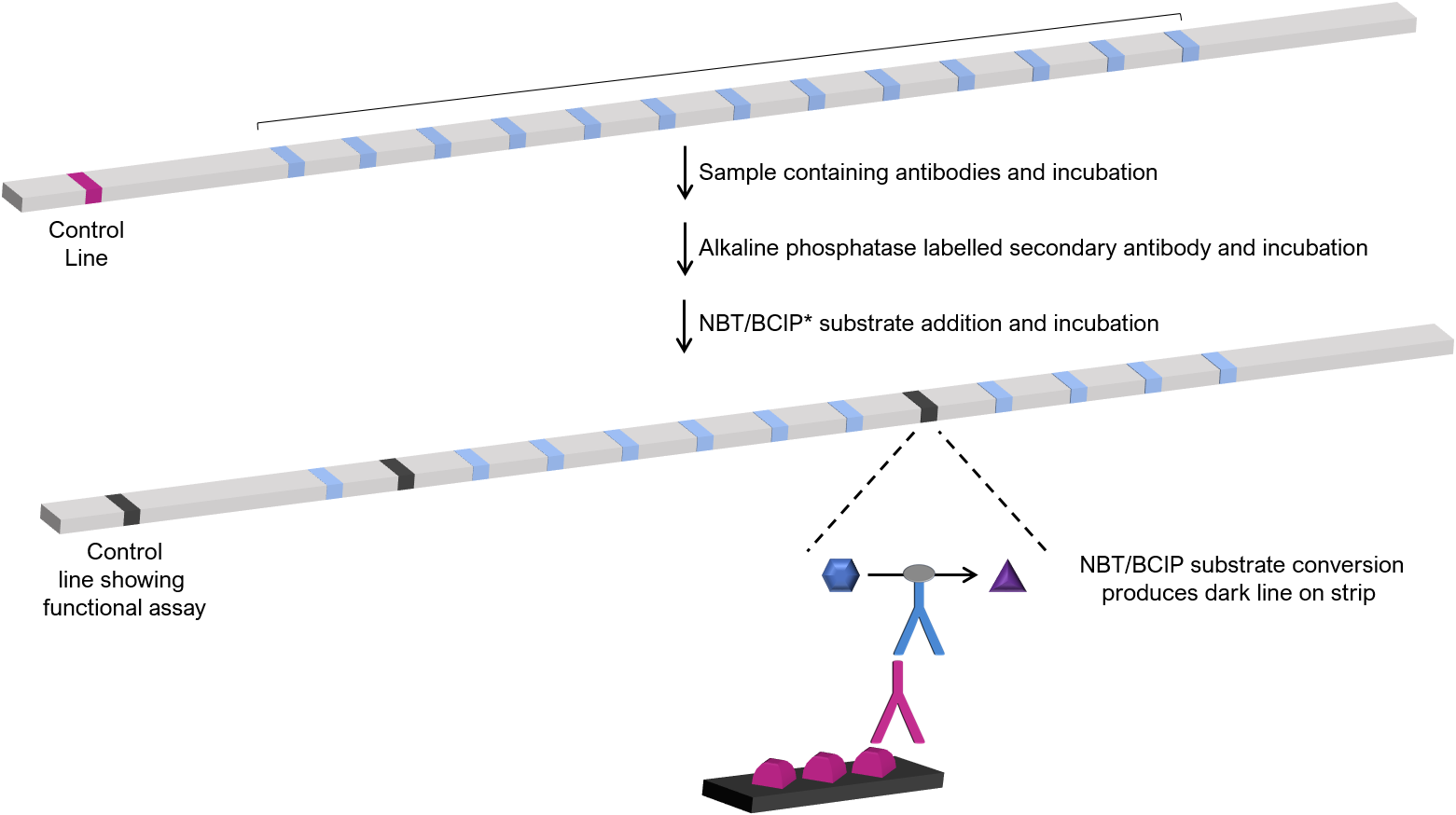

Pour effectuer le test, des échantillons dilués sont incubés sur la bande de test pour permettre la liaison des anticorps à l’antigène apparenté. L’ajout d’anticorps secondaires marqués à la phosphatase alcaline (ou à une autre enzyme telle que la peroxydase du raifort), suivi d’une incubation avec un substrat de chlorure de tétrazolium bleu nitro/5-bromo-4-chloro-3-indolyl phosphate (NBT/BCIP), entraîne la formation d’une ligne sombre à une position désignée de l’antigène, indiquant que l’échantillon contient des anticorps contre cet antigène. Traduit avec www.DeepL.com/Translator (version gratuite) La concentration d’anticorps est évaluée par densitométrie automatisée et est proportionnelle à l’intensité de la coloration sur la ligne d’antigène désignée.
Tests sur cellules
Les tests cellulaires sont basés sur des protocoles d’immunofluorescence indirecte (IIF) utilisant des cellules qui sont transfectées avec un vecteur contenant l’ADNc (ADN complémentaire) d’un antigène spécifique qui est ensuite surexprimé par les cellules. Les cellules transfectées contenant l’antigène sur-exprimé sont ensuite utilisées comme substrat IIF pour identifier les anticorps présents dans un échantillon de test.
Comment cela fonctionne-t-il ?
Les cellules liées à une surface de verre utilisées dans ces tests sont transfectées avec un vecteur contenant la région codant pour l’ADN d’un antigène de test spécifique d’intérêt. Les cellules exprimant l’antigène sont ensuite utilisées comme substrat pour l’IIF afin de détecter les anticorps pour l’antigène exprimé à partir d’un échantillon donné :
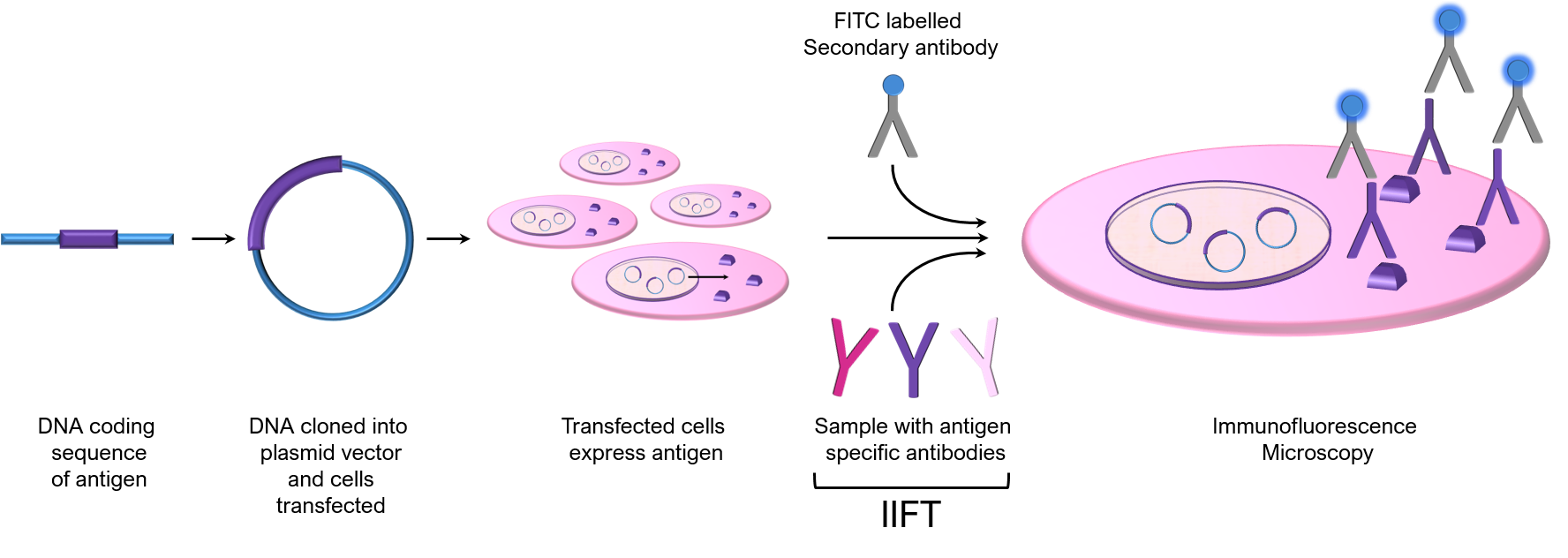

Les essais cellulaires offrent de nombreux avantages, notamment l’expression in vivo, le maintien d’épitopes conformationnels discontinus par un pliage approprié et des modifications post-traductionnelles, l’absence d’exigences de purification de l’antigène et la flexibilité dans le choix de l’antigène exprimé. Le multiplexage est également obtenu en combinant différentes cellules transfectées dans des réseaux cellulaires, ce qui permet la détection simultanée de plusieurs anticorps spécifiques à l’antigène dans un seul échantillon. Un autre avantage est qu’en général, toutes les cellules ne sont pas transfectées et qu’il est donc possible d’identifier une cellule « témoin » pour confirmer la spécificité du résultat de l’IIF observé. Alternativement, des cellules témoins transfectées avec le vecteur seul (pas d’ADNc) peuvent être ensemencées dans un puits adjacent pour confirmer la spécificité de la réaction IIF.
Tests Luminex
Les tests Luminex sont des immunoessais basés sur des microsphères (perles) capables de détecter plusieurs analytes dans un seul échantillon et un seul essai. Les tests Luminex sont utilisés dans une multitude d’applications de laboratoire clinique et de recherche qui requièrent une sensibilité et une précision élevées pour la détection d’analytes spécifiques. Associés à des capacités de multiplexage, ils offrent une rapidité, un débit, une précision et une polyvalence élevés qui optimisent la bioanalyse des échantillons.
Comment cela fonctionne-t-il ?
Le principe du test Luminex :
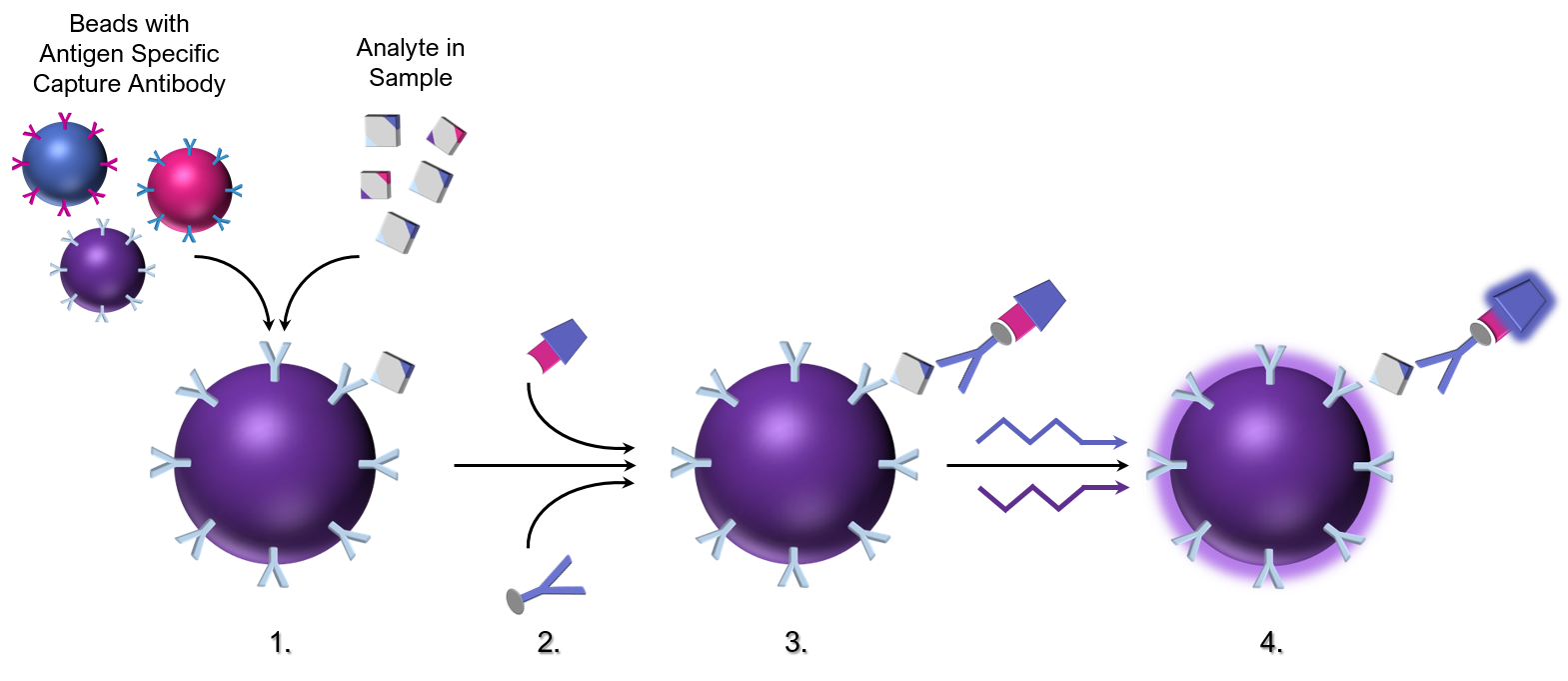

- Des billes colorées couplées à des anticorps de capture spécifiques à l’analyte (ou des antigènes si l’analyte étudié est un anticorps) sont mélangées à un échantillon d’essai. Les analytes spécifiques des anticorps sont capturés et liés aux billes.
- Les anticorps biotinylés secondaires spécifiques de l’analyte d’intérêt forment un complexe contenant la bille, l’analyte et l’anticorps de détection biotinylé secondaire. La phycoérythrine (PE), un colorant fluorescent conjugué à la streptavidine, est ajoutée et se lie à l’anticorps secondaire biotinylé. Alternativement, la phycoérythrine est directement couplée à l’anticorps secondaire, éliminant ainsi le fond potentiel dû à l’affinité naturelle de la biotine pour un certain nombre de protéines sériques.
- Pendant l’incubation de l’échantillon (suivie d’un lavage pour éliminer les anticorps non liés et les autres protéines) et l’étape suivante de production d’anticorps secondaires, un complexe marqué se forme sur la perle.
- Après avoir éliminé l’excès d’anticorps secondaires, les billes sont lues à l’aide d’un système de détection de flux à double laser ou d’une instrumentation à diodes électroluminescentes. Un laser distingue le signal spectral produit par des billes individuelles qui sont chacune marquées intérieurement avec un fluorophore unique qui produit une signature spectrale unique. Le second laser identifie et quantifie le second « signal » produit par la fluorescence du PE. Ainsi, le test permet la différenciation simultanée des populations individuelles de billes par leur signature spectrale ainsi que l’identification et la quantification des anticorps liés à la bille.
Cette plateforme technologique permet aux développeurs de tests de conjuguer des anticorps de capture (ou antigènes) distincts à des populations de perles spécifiques avec une signature distincte ou un colorant fluorescent. La combinaison de différentes populations de billes permet le multiplexage simultané pour la détection et la quantification de plusieurs analytes à partir d’une seule goutte d’échantillon. Ces caractéristiques font de la plateforme Luminex (et d’autres qui utilisent des principes similaires) l’un des systèmes les plus robustes et les plus rentables utilisés en bioanalyse.

